Minha senha
Por favor digite seu email cadastrado em nosso sistema que enviaremos uma nova senha de acesso.
Atualizado em 19/05/2022

INTRODUÇÃO:
Estudo observacional prospectivo de médicos para caracterizar o uso do teste de 21 genes na rotina clínica prática no Brasil e o impacto dos resultados do teste de 21 genes em recomendações de tratamento adjuvante e confiança do médico nessas recomendações.
MÉTODOS:
Os pacientes eram elegíveis se tivessem cancer de mama com pelo menos 18 anos e diagnosticado no estágio inicial, T1-2, ER +, HER2−, linfonodo negativo ou positivo. Pacientes tinham que ser candidatos para quimioterapia (QT) sistêmica e concordar em ter o teste genético feito como parte dos cuidados de rotina. Os pacientes deveriam ter dados disponíveis como idade, tamanho do tumor, grau do tumor, histologia do tumor, status linfonodal, status ER e PR por imunohistoquímica (IHC), e HER2 por IHC ou hibridização fluorescente in situ. Outras características clínico-patológicas (estado da menopausa, invasão linfovascular e Ki67 por IHC) foram coletados se acessível. Os pacientes eram inelegíveis se tivessem mais de um tumor de mama primário operável, tumor multifocal ou multicêntrico, câncer de mama metastático, terapia endócrina ou QT antes do teste de 21 genes.
RESULTADOS:
Entre agosto de 2018 e abril de 2019, as pesquisas foram concluídas com 179 pacientes no Hospital Pérola Byington e Santa Casa de Misericórdia de São Paulo. A idade média foi de 58 anos (variação de 29-86 anos), e 76% das pacientes estavam na pós-menopausa. Quase 1/3 dos pacientes (32%) apresentou câncer de mama com linfonodo positivo. A maioria (61%) tinha tumores >2 cm de tamanho e 12% tinham tumores de grau 3. Usando grupos RS definidos por pontos de corte de 18 e 31, 59% foram RS 0-17, 26% RS 18-30 e 15% RS 31- 100. Usando grupos TAILORx RS, 22% tinham RS 0-10, 51% RS 11-25 e 27% RS 26-100. Distribuição dos resultados do RS variaram de acordo com o estado linfonodal. Uma proporção maior de pacientes com ≥ 4 linfonodos positivos tiveram RS com maiores resultados (RS 31-100 ou RS 26-100) do que pacientes com menos ou nenhum linfonodo positivo.
Antes do teste de 21 genes, 162 pacientes (91%) foram recomendados para QT. Os regimes de QT mais frequentemente recomendados antes do teste foram 6 ciclos de fluorouracil, doxorrubicina e ciclofosfamida (55%) e 4 ciclos de doxorrubicina e ciclofosfamida mais docetaxel (31%). Após o teste, 117 pacientes (65%) tiveram uma mudança na recomendação de tratamento. Após o teste, 55 pacientes (31%) tiveram recomendação para QT, representando uma redução relativa de 66% nas recomendações de QT geral. Para esses 55 pacientes, os regimes de QT mais frequentemente recomendado foram 4 ciclos de doxorrubicina e ciclofosfamida mais docetaxel (44%) e 6 ciclos de fluorouracil, doxorrubicina e ciclofosfamida (38%). Entre os pacientes com câncer de mama linfonodo negativo (n=121), 79 pacientes (65%) tiveram uma mudança na recomendação do tratamento após o teste. Especificamente, 104 pacientes (86%) tinham recomendações para QT antes do teste, e 35 (29%) pacientes depois, representando um redução relativa de 66% nas recomendações de QT nesta coorte. Tinham 58 pacientes com câncer de mama com linfonodo positivo antes do teste de 21 genes; após o teste, 38 pacientes (66%) tiveram uma mudança na recomendação de tratamento. Apenas 20 pacientes (34%) receberam recomendações de QT após o teste, representando uma redução relativa de 66% nesta coorte.
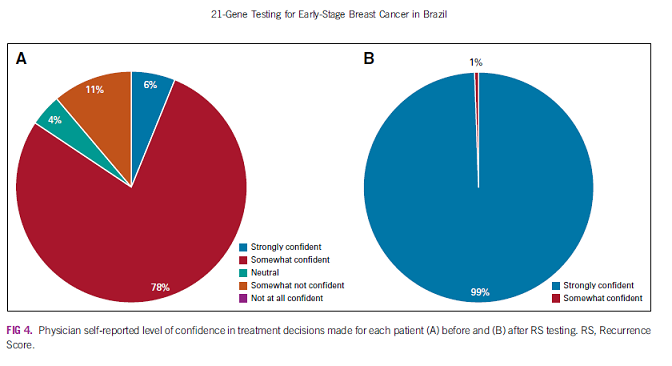
Recomendações de tratamento feitas antes do teste de 21 genes foram baseados no risco estimado por características clínico-patológicas. Uma comparação das recomendações de tratamento feitas antes e após o teste mostrou que a maioria dos pacientes, incluindo aqueles que teriam resultados RS inferiores (RS 0-17 ou RS 0-25 pelo corte TAILORx), tinha recomendações para QT antes que os resultados do RS fossem conhecidos, enquanto QT recomendado alinhado com o aumento do resultado RS uma vez incorporado na decisão de tratamento. Depois que os resultados da RS foram conhecidos, todos ou a maioria das recomendaçoes de tratamento para pacientes com resultados de RS mais baixos, particularmente RS 0-25, foram alterados para omitir QT, e algumas recomendações de tratamento para pacientes com RS 26-30 foram alterados para incluir QT. Antes e depois do teste de 21 genes, os médicos avaliaram seus nível de confiança nas recomendações de tratamento feitas para cada um de seus pacientes. Antes do teste, os médicos relataram sentir-se um pouco confiante (78%) ou fortemente confiante (6%) em 84% de suas recomendações de tratamento. Após o teste, os médicos relataram sentir-se fortemente confiantes em 99% de suas recomendações de tratamento.
DISCUSSÃO:
Dada a influência que os resultados da RS tiveram nas recomendações de tratamento e de confiança dos médicos, o teste de 21 genes demonstrou neste estudo ter utilidade clínica para pacientes com cancer de mama ER +, HER2− que são tratados no Brasil.
Quando os resultados de RS foram estratificados por categorias clínico-patológicas (tamanho do tumor, grau do tumor, idade e Ki67%), observamos um espectro de resultados RS dentro de cada categoria, incluindo aqueles tradicionalmente considerados de alto risco e categorias clínico-patológicas de baixo risco. Esta observação mostra que o risco clínico-patológico não corresponde ao risco genômico medido pelo teste de 21 genes. Figura 4 mostra que antes do teste de 21 genes, a maioria dos pacientes receberam recomendações para QT, mesmo pacientes que receberam RS baixos (RS 0-25) tinham recomendações de QT quando o risco era estimado com base apenas em fatores clínico-patológicos.
Em conclusão, este estudo demonstrou a utilidade clínica do teste de 21 genes para ajudar a orientar as decisões de tratamento para os pacientes no Brasil com cancer de mama linfonodo negativo ou positivo, ER +, HER2−. Ao todo, o ensaio permitiu aos médicos poupar a QT em um número substancial de pacientes no setor público do sistema de saúde brasileiro, reduzindo recomendações gerais de QT de 91% para 31%.
Bibliografia: Downloaded from ascopubs.org by
177.170.163.12 on June 28, 2021 from 177.170.163.012
Copyright © 2021 American Society of Clinical Oncology. See https://ascopubs.org/go/authors/open-access for reuse terms.

Mastologista pelo Instituto Brasileiro de Controle do Câncer (IBCC/SP) e membro da Sociedade Brasileira de Mastologia

Médico Ginecologista e Obstetra pela Pontifícia Universidade Católica de São Paulo (PUC-SP) e residente de mastologia pelo Instituto Brasileiro de Controle do Cancer (IBCC)

Residente de mastologia no Instituto Brasileiro de Controle do Câncer (IBCC) e membro da Sociedade Brasileira de Mastologia